Om den vetenskapliga artikeln:
Jönsson, M., et al: Engineered calcium-regulated affinity protein for efficient internalization and lysosomal toxin delivery. PNAS. 10.1073/pnas.2509081122
Du surfar just nu på en begränsad version av umu.se. Vad innebär det här?
NYHET Antikroppsläkemedel mot cancer är konstruerade för att ta sig in i tumörceller och frigöra ett toxiskt ämne djupt inne i cellen. Men i praktiken når de ofta inte ända fram. En ny studie visar hur denna ”trojanska häst”-strategi kan göras mer effektiv genom att utnyttja skillnaderna i kalciumkoncentration utanför och inne i celler.
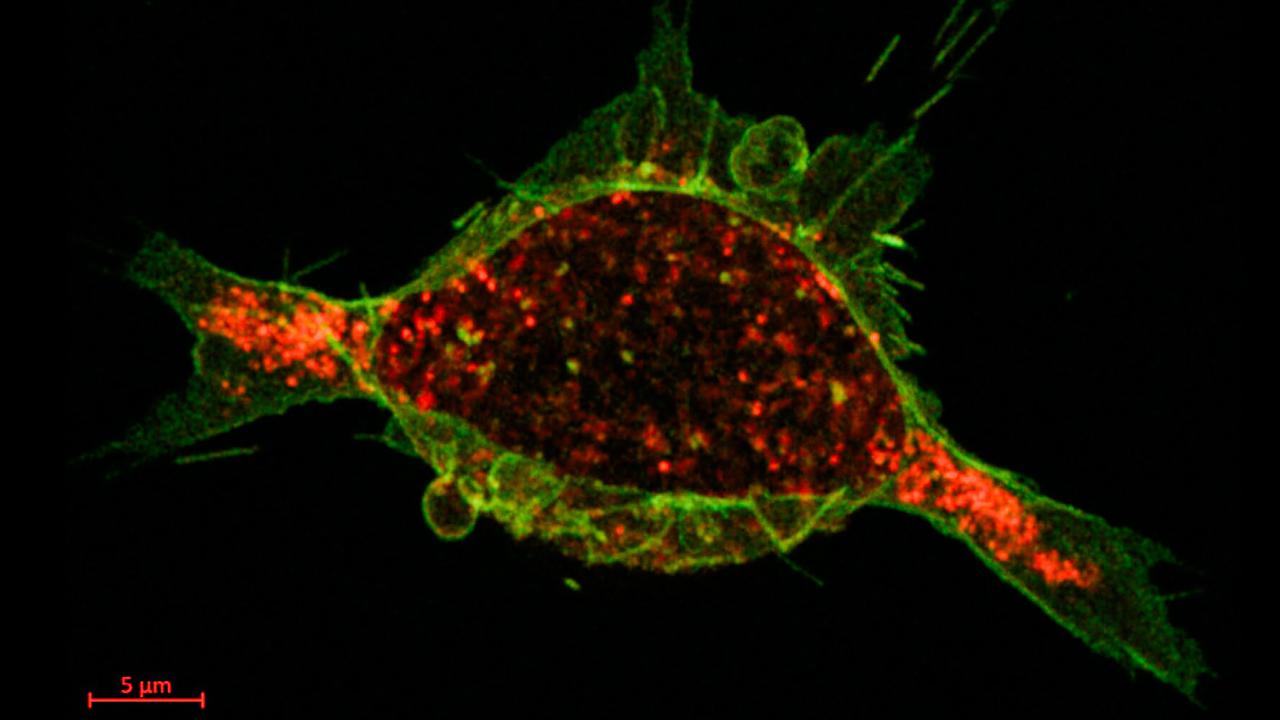
Det calciumreglerade läkemedlet (grönt) har fäst vid receptorerna (rött) på tumörcellerna, och nu börjar cellerna ta upp det – bara 40 sekunder efter att det gavs.
BildKTHKalciumswitchen är inbyggd i läkemedelsdesignen
Ett forskarteam från Kungliga Tekniska högskolan, KTH, Stanford University och Umeå universitet har utvecklat ett kalciumaktiverat leveranssystem med målet att möjliggöra mer riktad behandling, lägre läkemedelsdoser och mindre påverkan på frisk vävnad. Resultaten har publicerats i den vetenskapliga tidskriften PNAS.
Det nya konceptet adresserar ett vanligt problem med målsökande läkemedel: de binder alltför hårt till tumörernas receptorer, vilket hindrar dem från att nå sitt mål. Den starka bindningen kan visserligen blockera receptorns tumörtillväxtsignaler, men ADC:er (Antibody–Drug Conjugates) är egentligen avsedda att transportera sitt giftiga läkemedel till cellens egentliga mål – lysosomen, den organell där det målsökande proteinet bryts ned och toxinet frigörs, vilket är nödvändigt för att den avsedda celldöden ska ske.
För att lösa detta har forskarna utvecklat en kalciumkänslig molekylär “switch” som binder starkt till cancercellens receptor utanför cellen, där kalciumhalterna är relativt höga.
När det läkemedelsbärande proteinet (CaRA; calcium-regulated affinity) har bundit till EGFR (Epidermal Growth Factor Receptor) på cellytan tas komplexet in i cellen och förs in i små intracellullära blåsor där kalciumhalten gradvis sjunker. Eftersom bindningen är kalciumberoende lossnar CaRA från receptorn när koncentrationen av kalcium blir tillräckligt låg. Receptorn kan då återföras till cellytan, medan CaRA fortsätter sin färd mot lysosomen, som fungerar som cellens nedbrytningsstation, med sin läkemedelslast.
– Kalciumswitchen är inbyggd i läkemedelsdesignen. Den känner av kalciumnivån och anpassar sin bindning automatiskt, säger Sophia Hober, professor vid KTH som lett studien.

Från Umeå universitet är det professor Magnus Wolf-Watz grupp som deltagit i studien som publicerats i PNAS.
BildMattias PetterssonDe experimentella studierna gjordes på levande mänskliga cancercellinjer med det cytotoxiska ämnet mertansin DM1 kopplat till proteinet. Läkemedelskonjugatet visade mycket hög potens och var mycket selektivt – det dödade bara celler som uttrycker höga nivåer av EGFR och lämnade friska eller lågt EGFR-uttryckande celler opåverkade. Forskarna betonar att det visar på att läkemedlet känner igen målcellerna mycket bra och ger ett brett terapeutiskt fönster, vilket är avgörande för att begränsa biverkningar.
Leon Schierholz, som är doktorand i Magnus Wolf-Watz forskargrupp vid Umeå universitet, har bestämt en lågupplöst struktur av komplexet mellan CaRA; och den extracellulära domänen hos EGFR-receptorn. Strukturen har bestämts till en upplösning av cirka 6 Å med tekniken single particle cryoEM på data insamlade på Umeå Centre for Electron Microscopy, UCEM, vid Umeå universitet.
Strukturen ger en grundläggande molekylär förståelse av den höga affiniteten för komplexet.

Doktoranden Léon Schierholz har tillbringat många timmar vid det stora mikroskopet vid teknikplattformen UCEM vid Umeå universitet.
BildHans Karlsson– Nu går vi vidare och siktar på att komma fram med en högupplöst struktur med en upplösning under 3.5 Å som kan tillåta oss att göra en atomär modell som kan användas för att ytterligare förbättra egenskaperna hos CaRA. Data är av mycket bra kvalitet för detta förhållandevis lilla komplex, säger Leon Schierholz som i sammanhanget vill rikta spotlight på kollegan Max Renner som är högst delaktig i slutförandet av den atomära modellen.
Jönsson, M., et al: Engineered calcium-regulated affinity protein for efficient internalization and lysosomal toxin delivery. PNAS. 10.1073/pnas.2509081122
Detta är en teknik som används inom strukturbiologi för att bestämma strukturen hos biomolekyler som proteiner i deras nära-atomära upplösning. Metoden innebär att ett stort antal 2D-bilder av samma molekyl i olika orienteringar samlas in från frysta prover och sedan kombineras för att skapa en 3D-modell av molekylen.